景海春 研究组能源植物分子设计育种

景海春 研究员 博士生导师
办公室:新实验楼 W215
电子邮箱: hcjing@ibcas.ac.cn
电话:010-62836576
传真:010-62836576
课题组:植物分子设计研究组
个人简历:
1965年10月出生江西省九江市,1986年和1989年在 兰州大学获学士和硕士学位;
1989年到1996年 在天津市农业科学院土壤肥料研究所工作,历聘研究实习员,助理和副研究员,副所长;
1996年到1999年在荷兰瓦赫宁根DLO-CPRO(PRI)访问研究;
1999年至2004年在荷兰格罗宁根大学攻读博士并获得博士学位;
2004年到2008年在英国洛桑研究所做博士后;
2008年至今就职于中国科学院植物研究所资源重点实验室分子设计创新研究组课题组长,
目前,指导博士后1人,在读博士生和硕士生5人,联合培养博士生和硕士生3人。
主要研究内容:
目前主要开展甜高粱生物质能源性状的分子遗传研究。探索甜高粱糖代谢与生物量积累的发育调控,解析对非生物与生物逆境胁迫的分子应答,阐述抗逆性和糖代谢与生物量积累的关系,为分子设计育种拓宽植物抗逆性,提高光能利用率,增加和稳定生物量提供理论依据,基因资源和种质材料。
植物所甜高粱研究历史与进展
一、甜高粱简介
高粱(Sorghum bicolour)是世界第五大作物,是干旱及半干旱地区的主要粮食作物(FAO统计数据,stats.fao.org)。作为C4作物,高粱光合作用效率高,生物产量和经济产量大;此外,高粱具有强的抗逆性和适应性,素有‘作物中的骆驼(The camel amongst crops)’之称,具有抗旱、抗涝、耐盐碱、耐瘠薄、耐高温、耐寒冷等诸多特性。甜高粱(Sweet Sorghum)也叫芦粟、甜秫秸、甜秆和糖高粱,为普通粒用高粱的一个变种。甜高粱同普通高粱一样,可产籽实(每公顷2250~7500 kg),但它的显著特点在于富含糖分的茎秆(每公顷6000~75000 kg)。高粱基因组全序列已知,基因组相对较小,逐渐成为C4植物模式,为主要作物的遗传改良提供重要基因资源。

图1高粱籽实(左)及甜高粱秸秆(右)的形态特征
1、甜高粱生物学特性
与普通籽实高粱相比,甜高粱生长快、产量高,适应性和耐逆性更高,对土壤、肥料要求不高等优点。世界许多国家十分重视甜高粱育种与利用、积极研究并大力推广。甜高粱用种子繁殖,每亩0.3-0.5 公斤种子即可,且适于机播。甜高粱茎秆汁液锤度一般在16-22%之间,是优良的青贮饲料,对奶牛的产奶量有明显的增产效果。因其高的生物量和秸秆含糖量,甜高粱被认为是大有希望的甘蔗糖厂的补充原料,此外,籽粒或纤维可生产酒精或造纸。日本科学家研究发现每亩甜高粱每天合成的碳水化合物最高可产1.8升酒精,粒用高粱0.6升,而玉米只有1升,小麦为0.2升。每亩茎秆的产量用固体发酵法可生产50度的白酒300-400公斤。甜高粱秆亦可生产燃料酒精,是大有希望的生物新能源。甜高粱含有14-18%的纤维素,其产量每公顷达7.5-15吨,是纤维素或造纸的好原料。
甜高粱的这些显著特性使得其成为土地贫瘠、投入低下的农田生态系统中成功种植的重要能源和粮食作物,对国力不足的发展中的非洲和亚洲国家的能源粮食安全与农村发展起着重要作用。
2、甜高粱起源分类
在世界主要作物中,高粱是起源于非洲的作物,因此在作物起源进化和家驯化研究中有着重要地位。研究表明,苏丹和尼日利亚之间的南撒哈拉(Sub-Saharan Africa)是栽培高粱最初的起源地和种植区。栽培高粱于公元前3 000年从该地区扩散进入非洲西部热带地区,干旱的东北地区和非洲东南地区,此后高粱又经地中海传入印度、中国等地。高粱是我国最早栽培的禾谷类作物之一,有着千年历史。上世纪初,高粱已在中国普遍种植,曾经是主要粮食作物,遍布全国,主栽区在东北、华北、西北和黄淮流域的温带地区。
目前高粱分bicolor,drummondii和arundinaceum 3个亚种。栽培高粱来源于bicolor亚种,含5个地方宗(local races)和10个中间型(hybrid races)。5个地方宗分别是bicolor、kafir、caudatum、durra和guinea,它们都在不同程度上被用作育种的种质资源和基因库。甜高粱是普通籽实高粱的变种,在5个地方宗中均有,因而,目前普遍认为甜高粱是多起缘的(Polyphylogenic),这方面的研究尚需深入。
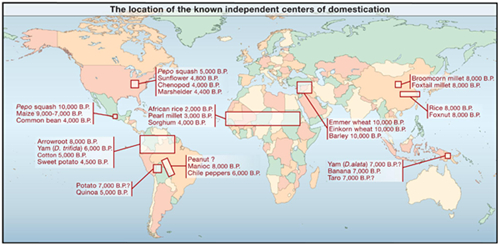
图2 高粱起源地及驯化时间(引自Doebley, et al., 2006, Cell,127:309-1321)
3、高粱是C4模式植物
高粱是一种重要的作物,是研究C4植物的模式。高粱全基因组序列已获得,美国DOE-JGI对一个籽实高粱自交系BTx623的基因组进行测序,结果显示,高粱基因组大约有3万个基因,有7.3亿个核苷酸,比水稻约多75%。高粱基因组测序的完成促进了高粱基础科学研究与遗传改良,并有助于其它相关植物的基因组学工作,如开展种内和种间比较基因组和进化基因组学的研究。高粱基因组约为730Mb,是迄今已知C4植物中具备全基因组信息的基因组相对较小的作物。其基因组在禾本科植物共同祖先分化后,未发生全基因组复制事件,相对而言,其基因组重复度和复杂程度较低,有利于开展基因功能发掘、功能基因组学研究。高粱有着诸多特异的生物学性状,如耐旱、耐瘠薄、高光效等,开展这些重要性状的功能基因组学,发掘其调控基因和代谢途径,有益于为其和其它重要作物的分子育种提供新基因、新种质和新思路。此外,高粱同其它重要的C4作物如甘蔗(Saccharum)、玉米、芒草(Miscanthus)和柳枝稷(Swtichgrass)等亲缘关系很近,这些作物的基因组相对较大、重复序列多、倍性高,可以利用高粱基因组与它们的高同源性开展功能基因研究和分子育种。虽然第一个高质量的高粱基因组序列已经公布,为开展基因组层面的研究提供了基础,但需要更多的高粱基因组信息才能深入分析遗传变异,真正为育种服务。
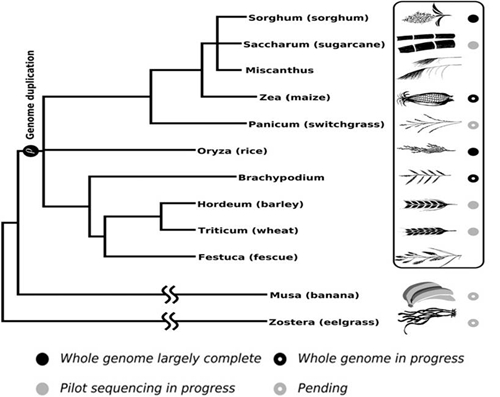
图3 高粱及其他驯化的谷类作物及两个外类群物种之间的亲缘关系
(引自Paterson et al., 2009, Plant Physiol. 149:125–131)
二、植物所甜高粱研究基础及进展
1、植物所甜高粱研究历史
甜高粱在中国的种植起源与传播目前尚无详尽的研究。有记载表明,我国崇明岛在18世纪有大面积甜高粱种植,其中一个名为‘琥珀’的甜高粱品种被传教士带入美国。大规模、有计划的甜高粱引种、选育、栽培示范工作始于二十世纪70年代。当时,从古巴得到的充足糖供应受到限制,中国科学院植物研究所黎大爵先生有感于甘蔗仅限于中国南方,努力寻找适宜北方种植的糖料作物。美国甜高粱育成的品种较多,资源丰富。因而,引进工作以美国品种为主,系统开展了甜高粱品种评价、筛选和育种。目前我国广泛种植和应用于育种的几十个主要的甜高粱均来自黎大爵先生等人的工作。正是这一系列的开创工作,极大促进了我国甜高粱的引种与选育。我国的甜高粱产量比北欧高1/3至1/2。中国已收集到70余个地方品种,多数属于早熟种,株高一般为250cm左右,高的300cm以上,锤度5%~17%,个别品种达20%以上,也有一些晚熟品种,如紫花芦穄是中国上海等地的地方品种,晚熟,在北京不抽穗,株高300cm以上,生物产量高,锤度达22%左右。
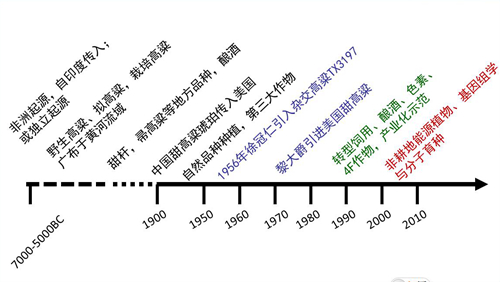
图4 中国(甜)高粱起源、栽培、育种和利用
中国科学院植物研究所的上述工作受到国内外的高度重视和支持。“九五”期间,在甜高粱研发领域承担了1项国家重点推广项目和2项中国科学院择优支持项目,完成了国际植物遗传资源委员会和FAO的12项国际合作研究项目;“十五”期间,黎大爵先生及谷卫彬博士等承担了中国科学院重点项目“甜高粱可持续农业系统研究”,承担了FAO重大项目“在干旱、盐碱地区种植甜高粱,生产粮食、食品、饲料、纤维和附加值副产品”,通过院地合作的形式在陕西省华阴建立了甜高粱种植育种基地和甜高粱汁液发酵生产酒精的小型加工生产线。1997年9月主持召开了在我国召开第一届国际甜高粱会议,收到论文140篇,出版了《第一届国际甜高粱论文集》和《甜高粱论文摘要集》两本甜高粱专著。在世界上首次提出“甜高粱可持续农业生态系统”的概念,并提出甜高粱以“燃料酒精”开发为主的循环产业化模式。同时发起并主持第一届国际甜高粱会议。

图5 中科院植物研究所科研人员撰写、收集及出版甜高粱相关书籍及论文集

图6 中科院植物研究所主持召开第一届国际甜高粱会议
2、甜高粱资源收集与评价
植物所自上世纪七十年代开始进行甜高粱资源收集及引种工作,陆续从美国,澳大利亚,德国,印度,日本,朝鲜,非洲等地引进甜高粱品种资源,并收集国内各省份的地方品种。近几年,扩大了国内外交流,t加新的种质资源。目前,植物所保存收集的甜高粱种质接近700份。
| 来源国别 | 份数 | 来源国别 | 份数 |
| 美国 | 82 | 德国 | 5 |
| 津巴布韦 | 50 | 澳大利亚 | 6 |
| 埃色俄比亚 | 27 | 印度 | 4 |
| 苏丹 | 26 | 日本 | 2 |
| 南非 | 9 | 朝鲜 | 3 |
| 肯尼亚 | 6 | 泰国 | 2 |
| 其它非洲国家 | 7 | 国内各省 | 41 |
| 俄罗斯 | 2 | 自选及其它 | 89 |

图7. 甜高粱品系进化树分析(A)及能源性状优良的甜高粱品种(B)株高5.2米以上甜高粱品种;(C)饲草甜高粱品种;(D)茎粗4厘米以上甜高粱品种
3、甜高粱新种质创制
(1)高粱诱变突变体
利用诱变育种等多种技术手段进行优良新种质的创制,经过多年杂交选育创制100多份新的甜高粱种质,获得抗旱,抗病,耐盐碱,高糖等性状的材料30份以上。

图8诱变育种进行优良高粱新种质的创制(A)EMS诱变的抗滨海、内陆盐碱突变体;(B)重离子辐射诱变的形态、抗旱突变体。
(2)杂交育种能源甜高粱
通过2006-2013年在海南三亚,北京一年两季的多年培育,总共组配了近两千个甜高粱杂交组合,筛选出综合性状突出,含糖量高,生物学产量高,抗性好的近十个甜高粱杂交组合。近两年陆续开始全国多点的区域试验。
“科甜系列”新优甜高粱杂交品种

| 品种名称 | 茎秆亩产 (千克) | 籽粒亩产 (千克) | 糖含量 | 生育期(天) | 主要特点及品种审定 |
| 科甜一号 | 6500 | 280 | 19% | 137 | 2009-2011年新疆自治区完成小区试验和区域试验,并于2011年完成新疆自治区组织的专家田间鉴定工作,预计今年发放新品种证书。 |
| 科甜三号 | 5000 | 220 | 16.8% | 135 | 于2010年参加全国高粱品种审定委员会组织的全国区域试验,在全国15个点的区域试验中综合排名第四位。正在积极申报新品种。 |
| 科甜四号 | 4500 | 250 | 20 | 115 | 早熟,含糖量高,拟于今年在东北西北等生长期短的地区进行品种审定。 |
| 科甜六号 | 6800 | 300 | 18 | 145 | 生育期较长,但茎秆亩产接近七吨,抗病性强。 |
4、植物所甜高粱基础研究
(1)甜高粱基因组重测序及比较基因组学分析
2009年植物所开展了甜高粱基因组的重测序比较基因组学研究;利用新一代测序技术对2个甜高粱和1个籽实高粱品系进行了基因组重测序,参考已有的1个籽实高粱序列,比较发现甜高粱和籽实高粱间近1500个基因存在差异,这些基因参与糖与淀粉代谢、木质素和香豆素合成、核酸代谢、胁迫应答和DNA修复等活动。此外,还发掘出1,057,018个SNPs, 99,948个1-10bp小片段缺失,16,487个大片段获得与缺失变异(PAV)。这些结果将为深入研究基因组变异如何影响生物学性状,建立基因—性状关联和开展高粱分子育种提供依据。
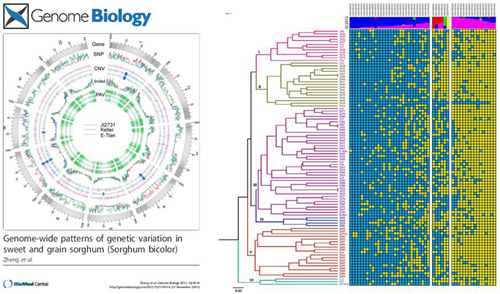
图9甜高粱基因组重测序(A,引自zheng et al., 2011, Genome Biology. 12:R114)及大片段获得与缺失变异遗传学研究(B,文章在线发表于Journal of Integrative Plant Biology)
(2)高粱遗传转化体系建立
建立稳定的高粱遗传转化体系,为高粱关键基因的功能分析提供研究基础。

图10 高粱遗传转化体系建立
(3)高粱重要功能基因挖掘与功能分析
1)高密度遗传图谱的构建
利用基因组重测序结果发展高密度分子标记共377个,其中Indel标记323个,SSR标记54个,总长1332.1cM,为开发和利用全基因组标记打下了基础。这些标记已用于我们相关研究内容中,如种质遗传多样性分析、秸秆性状和衰老QTL定位等。
2)抗逆功能基因发掘
以甜高粱定向遗传改良为中心,旨在为培育耐盐碱耐干旱新品种提供育种新材料。我们通过对甜高粱抗逆性的研究,发掘甜高粱耐盐碱、叶片衰老相关基因,整合甜高粱的强抗逆性,高含糖量和大生物量的能源性状,为在边际土壤实现甜高粱规模化生产提供新基因和种质资源。
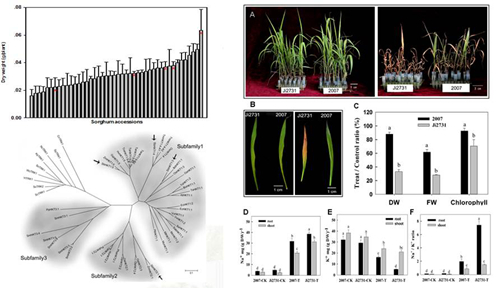
图11 甜高粱耐盐碱种质资源筛选及高粱HKT基因家族克隆及功能分析
(文章在线发表于Journal of Integrative Plant Biology)
3)秸秆性状的遗传调控
甜高粱的秸秆通常含有高的含糖量(锤度),这是甜高粱秸秆明显区别于籽实高粱的重要特征。明了该性状的分子遗传调控机制将极大促进甜高粱的遗传改良。这是我们实验室研究的重点之一。
5、植物所早期甜高粱全国区域试验及推广种植工作
中科院植物所是国内最早开展甜高粱育种和新品种推广应用研究的单位,作为九五重点推广项目的技术依托单位,在全国15个省份以上进行推广种植和综合加工利用技术应用研究,累计推广甜高粱优良品种种植面积达50万亩以上。推广的甜高粱优良品种主要有:M-81E、雷伊、凯勒、意达利、考利、雷能、BJ-8、BJ-55,BJ-21等;亩产茎秆5吨以上。植物所早期,谷卫彬博士等通过院地合作的形式与国内不少大的能源公司如中石油、中粮集团、中兴能源、武汉凯迪等在河北、山东、内蒙、吉林、甘肃等全国大部分地区开展了甜高粱区域种植和示范试验,并初步建立了甜高粱乙醇中试生产车间,取得了明显的经济和社会效益。
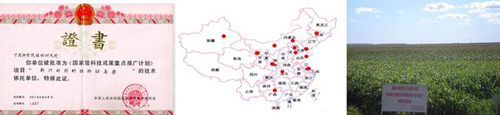
图12. 植物所甜高粱全国示范推广工作成绩。左图,获国家证书,中间图示,推广至全国大部分的示意图,右图,示范区展示例图。
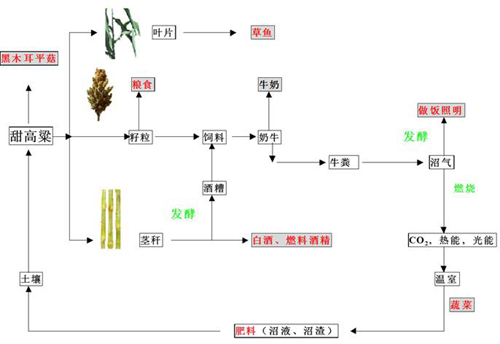
6、甜高粱的综合利用研究
(1)能源(燃料乙醇、酿酒)
在联合国项目的执行过程中,建立了甜高粱种植与育种基地。采用巴西先进的发酵技术,建成了用甜高粱汁液发酵生产酒精的小型加工中试生产线。陕西建成的用甜高粱汁液、循环发酵法生产酒精中试车间。

图13. 甜高粱多功能应用示范。左图,中间和右边为黎大爵先生、谷卫彬副研究员;中间图示,陕西甜高粱生物乙醇示范厂;右图,甜高粱酒。
(2)饲料 (青贮饲料、酒渣饲料)
青贮甜高粱的营养价值只比精饲料降低3-10%,牲畜使用青贮甜高粱秸秆比使用晒干秸秆增加消化率20%左右。青贮饲料可以很好保持饲料青绿时期的鲜嫩汁液。一般干草汁只有14-17%,青贮饲料的含量可达60-70%,既保持原有品质,又可产生酸、甜及特殊的清香味,提高消化吸收率。

图13. 天津工农联盟奶牛场试验甜高粱饲料应用示范。
(3)甜高粱可持续农业生态系统研究
(4)甜高粱燃料酒精循环经济产业模式
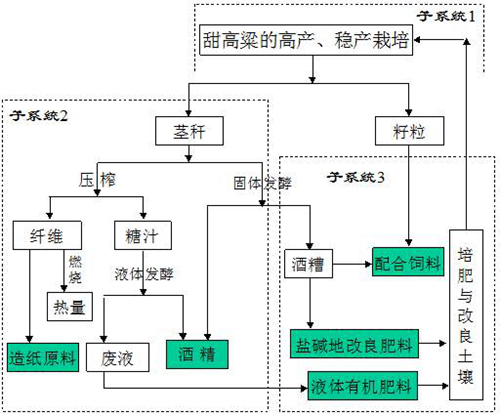
7、国内外合作与交流
植物所在高粱基因组学、生物信息学、抗逆基因功能分析、遗传转化体系建立、分子遗传育种等方面大力同国内外同行开展合作研究。同时,联合培养博士研究生。


发表论文:(注*为通讯作者)
Luo H, Zhao WM, Wang YQ, Xia Y, Wu XY, Zhang LM, Tang BX, Zhu JW, Fang L, Du ZL, Bekele WA, Tai SA, Jordan DR, Godwin ID, Snowdon RJ, Mace ES, Jing HC*, Luo JC* (2016) SorGSD: a sorghum genome SNP database. Biotechnol Biofuels 9
Wu XY, Hu WJ, Luo H, Xia Y, Zhao Y, Wang LD, Zhang LM, Luo JC*, Jing HC* (2016) Transcriptome profiling of developmental leaf senescence in sorghum (Sorghum bicolor). Plant Mol Biol 92: 555-580
Schippers JH, Schmidt R, Wagstaff C, Jing HC (Co-first author) (2015). Living to die and dying to live: The survival strategy behind leaf senescence. Plant Physiol, DOI:10.1104/pp.15.00498.
Zheng L, Shang L, Chen X, Zhang L, Xia Y, Smith C, Bevan MW, Li Y, Jing HC:*(2015). TANG1, Encoding a Symplekin_C Domain-Contained Protein, Influences Sugar Responses in Arabidopsis. Plant Physiol. 168(3):1000-1012.
Shen X, Liu ZQ, Mocoeur Anne, Xia Y, Jing HC*(2015). PAV markers in Sorghum bicolour: Genome pattern, affected genes and pathways, and genetic linkage map construction. Theoretical and Applied Genetics. 128(4): 623-637.
Wu L, Li M, Huang J, Zhang H, Zou W, Hu S, Li Y, Fan C, Zhang R, Jing HC, Liang CP, Sheng QF*(2015). A near infrared spectroscopic assay for stalk soluble sugars, bagasse enzymatic saccharification and wall polymers in sweet sorghum.Bioresource technology. 177:118-124.
Anami SE, Zhang L-M, Xia Y, Zhang Y-M, Liu Z-Q, Jing HC*(2015). Sweet sorghum ideotypes: genetic improvement of stress tolerance. Food and Energy Security. 4(1):3-24.
Mocoeur A, Zhang YM, Liu ZQ, Shen X, Zhang LM, Rasmussen SK, Jing HC*(2015). Stability and genetic control of morphological, biomass and biofuel traits under temperate maritime and continental conditions in sweet sorghum (Sorghum bicolour). Theor Appl Genet. 128:1685–1701.
Zhang LM, Luo H, Liu ZQ, Zhao Y, Luo JC, Hao DY, Jing HC*(2014). Genome-wide patterns of large‐size presence/absence variants in sorghum. Journal of Integrative Plant Biology, 56:24-37.
罗洪,张丽敏,夏艳,吴小园,王聪,刘智全,景海春*(2015).能源植物高粱基因组研究进展.科技导报.Vol.33 (16): 17-26.
Zhang LM, Luo H, Liu ZQ, Zhao Y, Luo JC, Hao DY, Jing HC*(2014). Genome-wide patterns of large‐size presence/absence variants in sorghum. Journal of Integrative Plant Biology, 56:24-37.
Wang TT, Ren ZJ, Liu ZQ, Feng X, Guo RQ, Li BG, Li LG, Jing HC*(2014). SbHKT1; 4, a member of the high‐affinity potassium transporter gene family from Sorghum bicolor, functions to maintain optimal Na%2b/K%2b balance under Na%2b stress. Journal of Integrative Plant Biology, 56:315-332.
Luo H, Mocoeur A, Jing HC*(2014). Next-Generation Sequencing Technology for Genetics and Genomics of Sorghum.Genetics, Genomics and Breeding of Sorghum 2014:226. (Book chapter)
Li M, Feng S, Wu L, Li Y, Fan C, Zhang R, Zou W, Tu Y, Jing HC, Li S*(2014): Sugar-rich sweet sorghum is distinctively affected by wall polymer features for biomass digestibility and ethanol fermentation in bagasse. Bioresource technology, 167:14-23.
Zhang L-M, Liu X-G, Qu X-N, Yu Y, Han S-P, Dou Y, Xu Y-Y, Jing H-C*, Hao D-Y*(2013). Early transcriptomic adaptation to Na2CO3 stress altered the expression of a quarter of the total genes in the maize genome and exhibited shared and distinctive profiles with NaCl and high pH stresse. Journal of Integrative Plant Biology, 55(11): 1147–1165
Tahir J, Watanabe M, Jing HC , Hunter DA., Tohge T, Nunes-Nesi A., Brotman Y, Fernie A. R., Hoefgen R. and Dijkwel PP (2013), Activation of R-mediated innate immunity and disease susceptibility is affected by mutations in a cytosolic O-acetylserine (thiol) lyase in Arabidopsis. The Plant Journal 73: 118–130. doi: 10.1111/tpj.12021
&%23160;
Jing HC, Nam HG (2012). Leaf Senescence in Plants: From Model Plants to Crops, Still so Many Unknowns. Journal of Integrative Plant Biology. 54(8):514-515
Zheng LY, Guo XS, He B, Sun LY, Peng Y, Dong SS, Liu TF, Jiang SY, Ramachandran S, Liu CM and Jing HC* (2011) Genome-wide patterns of genetic variation in sweet and grain sorghum (Sorghum bicolour). Genome Biology,12(11)R114
Zheng LY, Guo XS, He B, Sun LY, Peng Y, Dong SS, Liu TF, Jiang SY, Ramachandran S, Liu CM and Jing HC* (2011) Genome data from sweet and grain sorghum (Sorghum bicolour). GigaSciencehttp://dx.doi.org/10.5524/100012.
Shirzadian-Khorramabad R, Jing HC(Co-first author), Everts GE, Schippers JHM, Hille Jand Dijkwel PP (2010) A mutation in the cytosolic O-acetylserine (thiol) lyase induces a genome-dependent early leaf death phenotype in Arabidopsis.BMC Plant Biology 10:80 doi:10.1186/1471-2229-10-80
Jing HC *, Bayon C, Kanyuka K, Berry S, Wenzl P, Huttner E, Kilian A and Hammond-Kosack KE. (2009) DArT markers: diversity analyses, genomes comparison, mapping and integration with SSR markers in Triticum monococcum. BMC Genomics 10:458, doi:10.1186/1471-2164-10-458
Hofinger BJ, Jing HC, Hammond-Kosack KE and Kanyuka K. (2009) High-resolution melting analysis of cDNA-derived PCR amplicons for rapid and cost-effective identification of novel alleles in barley. Theor Appl Genet 119 (5): 851-865
Jing HC, Hebeler R, Oeljeklaus S, Sitek B, Stühler K, Meyer HE, Sturre MJG, Hille J, Warscheid B, Dijkwel PP. (2008) Early leaf senescence is associated with an altered cellular redox balance in Arabidopsis cpr5/old1 mutants. Plant Biology 10 Suppl 1:85-98. (Plant Senescence Special Issue)
Jing HC and Dijkwel PP. (2008) CPR5, a jack of all trades in plants. Plant Signaling & Behavior 3: 562–563.
Jing HC, Lovell D, Gutteridge R, Jenk D, Kornyukhin D, Mitrofanova OP, Kema GHJ and Hammond-Kosack K (2008) Phenotypic and genetic analysis of Triticum monococcum – Mycosphaerella graminicola interaction. New Phytologist 179:1121-1132.
Jing HC, Anderson L, Sturre MJG, Hille J and Dijkwel PP(2007) Arabidopsis CPR5 is a senescence-regulatory gene with pleiotropic functions as predicted by the evolutionary theory of senescence. J. Exp. Bot. 58:3885-94. Epub 2007 Nov 22.
Jing HC, Kornyukhin D, Kanyuka K, Orford S, Zlatska A, Mitrofanova OP, Koebner R and Hammond-Kosack K (2007) Identification of variation in adaptively important traits and genome wide analysis of trait-marker associations in Triticum monococcum. J. Exp. Bot. 58:3749-64.
Schippers JHM, Jing HC (Co-first author), Hille J, and Dijkwel PP (2006) Developmental and hormonal regulation of leaf senescence. In Senescence Processes in Plants. Blackwell publisher. (Book chapter)
Jing HC, Lovell D, Kornyukhin D, Kanyuka K, Tearall K, Phillips A, Orford S, Koebner R, Mitrofanova OP, and Hammond-Kosack K. (2005) New approaches for durable disease resistance in wheat, Proceeding of the BCPC International Congress & Exhibition – Crop Science & Technology. P963-970.
Jing HC, Schippers JHM, Hille J, and Dijkwel PP (2005) Ethylene-induced leaf senescence depends on age-related changes and OLD genes in Arabidopsis, J. Exp. Bot. 56:2915-23
Jing HC, Hille J and Dijkwel PP (2003) Ageing in plants: conserved strategies and novel pathways, Plant Biology 5, 455-464.
Jing HC, Sturre MJG, Hille J and Dijkwel PP(2002) Arabidopsis onset of leaf death mutants identify a regulatory pathway controlling leaf senescence. The Plant J. 32, 51-64.